Nomenclature
: specific heat
: diffusion coefficient
: particle diameter
: fusion ratio
GR : global reaction
: convective heat transfer coefficient
: molar mass
: nusselt number
: molar density of boron oxide
: prandtl number
: equilibrium vapor pressure
: heat of global reaction i
: molar reaction rate of global reaction i
: reynolds number
: universal gas constant
: particle radius
: boiling point
: melting point
: particle temperature
: environmental temperature
: burn time
: combustion time
: ignition time
: mole fraction of
: mole fraction of
: equilibrium mole fraction
: boron oxide layer thickness
𝛼 : reaction probability
𝜀 : emissivity
𝜃 : oxygen diffusion factor
𝜆 : thermal conductivity
𝜈 : hertz-knudsen factor
𝜌 : density
𝜎 : stefan-boltzmann constant
: enthalpy of boron evaporation
1. 서 론
고체 연료의 추진 성능을 향상하기 위해 금속 입자를 첨가하여 사용하는데, 보론은 독성 물질을 생성하는 베릴륨과 높은 반응성의 리튬을 제외한 금속 입자 중 단위 체적당 열량이 높아 첨가제로 주목받고 있다[1]. 그러나, 보론 입자는 액체 산화막 층으로 인해 산소와의 접촉이 차단되어 점화시간이 지연되고 높은 점화 에너지가 필요하다. 또한, 산화막이 제거된 후에도 보론의 높은 비등점으로 인해 연소율이 낮아 점화 및 연소에 어려움이 있다[2]. 보론의 효과적인 활용을 위해서는 연소기 내 체류시간 안에 완전히 연소가 되어야 하므로 효율적인 보론 입자 연소를 위해 보론 입자의 연소 현상에 대한 이해가 필요하다.
보론 입자 연소 모델링은 크게 두 가지 유형으로 구분된다. 첫 번째 유형은 자세한 반응단계와 입자 환경을 고려한 포괄적인 모델로 광범위하고 자세한 계산을 통해 시간에 따른 반응물, 생성물 및 중간 생성물에 대한 경향을 얻을 수 있으나, 전산유체해석에 적용하기엔 매우 복잡하다. Brown 등[3,4]은 탄화수소-공기 조성에서 보론 단일 입자의 비균질 반응 메커니즘 연구하였으며, Yeter 등[5,6]은 플루오린(F), 질소를 포함하는 조성에서의 반응을 고려한 반응모델을 제시하였다. 두 번째 유형은 소수의 총괄 반응 메커니즘을 사용한 모델로 시간에 따른 입자 크기, 산화막 두께, 입자 온도와 같은 매개 변수 영향을 알 수 있으며 전산유체해석에 적합하다. 이를 기반으로 하는 연구는 팬실바니아주립대학(PSU: Pennsylvania State University) 그룹 등에 의해 보고되었으며 최근까지 지속적으로 수행되고 있다. Yeh 등[7]은 실험 결과를 근거로 보론 산화막의 주요 증발 생성물로 가 아닌 를 고려한 반응 모델을 제시하였다. Ulas 등[8]은 이를 기반으로 플루오린을 포함하는 다양한 산화제 조성에 대한 모델을 제시했으며, 점화 지연 시간을 성공적으로 계산하였다. Hussmann 등[9]은 PSU 그룹 모델을 확장하여 강제 대류 및 보론 증발의 영향을 고려한 모델을 개발하였다. Chen 등[10]은 PSU 그룹의 모델을 기반으로 점화 단계에서 표면 보론 폴리머의 평형, 연소 단계에서 보론 입자의 증발 및 비등 과정을 포함한 모델을 제시하였다.
본 연구에서는 기존 여러 논문들에서 제시된 보론 연소 모델링들을 조사하여 보론 연소의 수치해석 모델을 구성하였다. 기존의 타 모델링 비하여 실험결과에 더 부합하는 Chen 등[10]의 모델을 기반하되, Chen 등[10]의 모델에서 간과한 액체 산화막을 통해 확산되는 산소와 보론 입자의 반응[11]을 고려하여 산화막 생성 과정을 개선하였다. 또한, 보론이 높은 온도에서의 비등 현상이 이루어짐을 착안하여 Clausius –Clapeyron 방정식을 적용하여 보론 연소의 전과정을 수치적으로 연구하였다. 제안된 모델을 검증하기 위하여 선행 연구에서 제시된 실험결과와 해석 모델링의 결과와 비교하고, 보론 입자의 연소 반응율의 특성을 분석하였다.
2. 보론입자의 연소특성
Macek[12]은 평면화염 버너 실험을 통해 보론 연소는 두 개의 연속적인 단계로 진행된다는 것을 확인하였다. 1차 단계에서 보론 입자가 짧은 시간 동안 발광하다 희미해지는 현상이 관찰되었다. 연소에 충분한 산화제 및 높은 온도가 주어지면 2차 단계인 연소 단계로 진입하며 1차 단계보다 훨씬 밝고 길게 발광한다는 것을 관찰하였다.
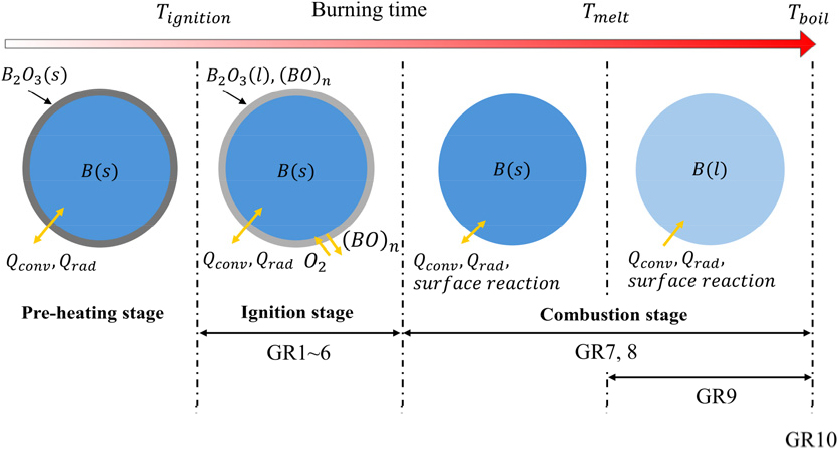
Fig. 1은 보론의 연소를 단계별로 도식적으로 나타내었다. 보론을 둘러싼 산화막이 존재하며 보론 입자가 주변의 높은 온도로 인해 대류 및 복사로 가열되며 충분한 에너지가 공급되면 (Preheating stage) 보론입자를 둘러싼 산화막이 액체로 융해된다. 보론과 산화막 경계에서 보론은 산화막으로 융해되고, 산화막과 외기 경계에서 산소는 산화막으로 용해된다. 융해된 보론과 용해된 산소는 산화막을 통해 양방향으로 확산되어 각 경계면에서 산화반응이 발생하여 산화막이 줄어든다. 이를 점화 단계(Ignition stage)라 불린다[13]. 산화막이 모두 제거된 후 순수 보론 입자가 연소되는 단계로, 연소 단계(Combustion stage)라 불린다. 보론의 연소 단계는 확산과 화학반응을 통해 진행되며 Yeh 등[7]은 연소에 지배적인 역할은 수(Eq. 1)를 통해 도출하였다. 일 때는 반응속도 지배 연소로 법칙을 따라 연소되고, 일 경우 확산지배 연소로 법칙을 따라 연소 됨을 관찰하였다.
3. 보론 연소모델
보론 입자는 점화 온도에 도달할 때까지 표면 반응이 일어나지 않으며 고온 외기 환경에서 대류와 복사로 가열되므로 입자의 온도 변화를 다음과 같이 모델링할 수 있다[8]. 대류 열전달 계수 는 Eq. 3을 통해 계산하였다.
3.1 점화 단계
여러 실험적 연구에 의해 밝혀진 점화 온도는 1500~ 900 K의 범위를 갖는다[14]. 본 연구에서는 보론의 점화 온도는 1650 K로 설정하였다. 산화막 두께는 입자 반경의 1.3%로 사용하였으며, 직경 3 미만인 경우는 0.02 으로 설정하였다[10]. 점화 단계는 Eq. 4, 5, 6, 7, 8, 9의 6가지 반응식으로 모델링하였다.
(GR1)
(GR2)
(GR3)
(GR4)
(GR5)
(GR6)
GR1~GR4 반응률은 Hertz-Knudsen 방정식으로 표현된 화학 반응과 확산에 의해 결정된다. GR1은 액체 보론 산화막의 증발 과정을 나타내며 반응률은 Eq. 10과 같다[7,10].
GR2와 GR3는 액체 산화막을 통해 일어나는 표면반응을 나타내며 반응률은 각각 Eq. 11, Eq. 12와 같다[15].
GR4는 액체 산화막의 증발 과정을 나타내며 반응률은 Eq. 13과 같다[15,16].
GR5는 액체 산화막과 수증기의 표면 반응을 나타내며 반응률은 Eq. 14와 같다[10].
GR6는 액체 산화막을 통해 확산된 산소와 보론 입자의 반응을 나타내며 반응률은 Eq. 15와 같다[11,17].
Eqs. 10, 11, 12, 13, 14, 15로 구한 반응률을 사용하여 점화 단계에서 보론 입자의 크기 변화는 보론 입자의 크기 변화 관계된 반응식 GR1, GR2, GR3, GR6으로 부터 Eq. 16과 같다. 보론 입자의 산화막 두께의 변화는 산화막 두께의 변화 관계된 반응식 GR1, GR3, GR4, GR5, GR6으로 부터 Eq. 17과 같으며, 보론 입자의 온도는 반응열, 대류와 복사열을 고려하여 Eq. 18과 같다.
3.2 연소 단계
연소단계는 Eq. 19, 20, 21, 22의 4가지 반응식으로 모델링할 수 있다.
(GR7)
(GR8)
(GR9)
(GR10)
보론의 표면 반응을 나타내는 반응인 GR7, GR8의 반응률은 반응속도 지배 반응과 확산지배 반응을 고려한 Eq. 23로 표현되며 각 반응률은 Eq. 24, 25, 26, 27로 계산한다[10].
GR9은 보론의 증발 과정을 나타낸다. GR1~GR4 반응률과 마찬가지로 화학 반응과 확산에 의해 반응률이 결정되며 Eq. 28와 같다[10,18].
보론이 비등점에 도달할 경우 표면 반응으로 인한 반응열이 비등에 사용된다. GR10은 보론의 비등과정을 나타낸다. Eq. 25, 28에서 사용되는 확산계수는 Chapman- Enskog 방법으로 계산하였다[19].
보론 입자의 크기 변화는 보론 입자의 크기 변화 관계된 반응식 GR7, GR8, GR9, GR10으로 부터 Eq. 29와 같으며, 온도 변화는 Eq. 30에서 구할 수 있다.
4. 결 과
4.1 모델 검증
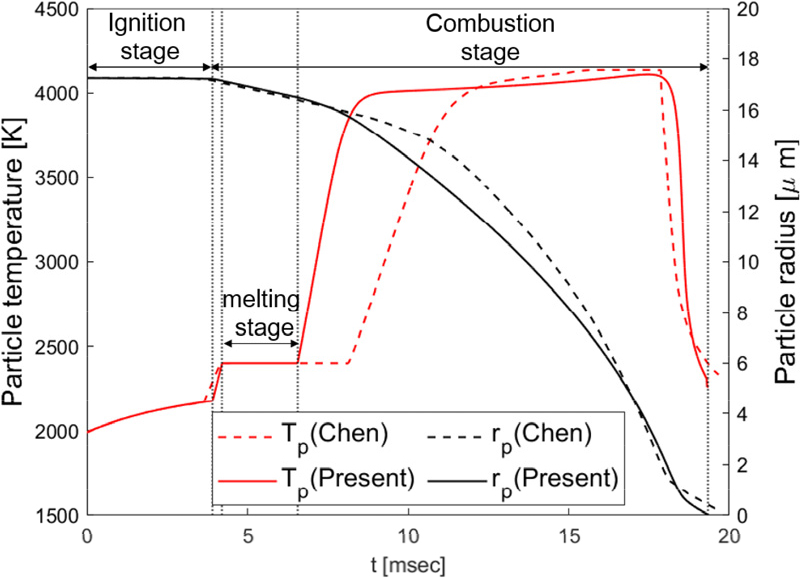
보론 연소모델 검증을 위해 선행연구의 결과와 입자의 온도 및 입자 크기의 변화를 비교하였다. Fig. 2는 외기 온도 2280 K, 보론 입자 직경 34.5 , 산소 몰분율 0.23, 입자-가스 상대속도 2.0 m/s일 때, Chen 연구진의 결과와 비교한 그래프이다. 점화 단계는 온도와 입자 직경은 크게 변하지 않으며, 산화막 두께가 감소한다. 산화막이 모두 제거된 연소 단계에서 온도는 급격히 상승하여 녹는점에 도달한다. 이는 Macek[11]가 실험적으로 관찰한 보론 연소가 두 개의 연속적인 단계로 진행된다는 것과 일치한다. 융해(melting) 단계에선 반응열로 인해 보론 입자가 융해되며, 모두 융해될 때까지 온도 변화가 없다. 이후 온도가 급격히 상승한다. 입자 온도가 상승함에 따라 대류와 복사에 의해 에너지 변화율이 감소하므로 약 4000 K 이후 온도 변화 기울기가 감소한다. 이후, 입자 직경 감소에 따른 대류 열전달 계수 증가로 보론 입자에서 주위로의 대류 열전달이 증가하여 입자 온도가 급격히 감소하고, 입자는 모두 소모된다. 고려한 반응식 및 물성치 계산 방법에 따른 차이로 Chen 연구진의 결과와 그래프 개형이 차이가 나지만, 총 연소시간은 거의 유사하게 계산되었다.
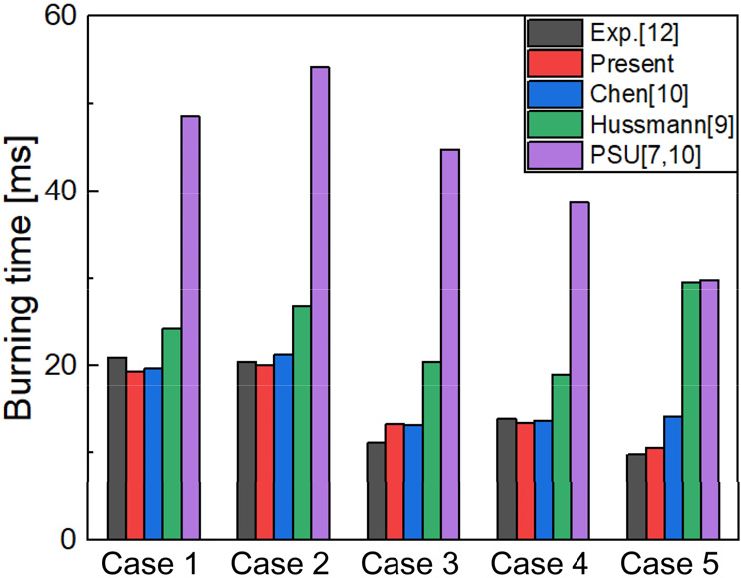
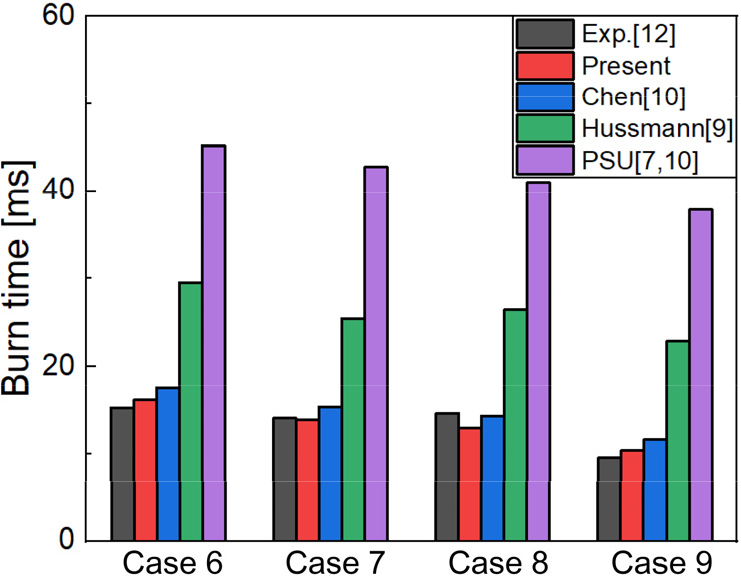
선행 연구와 총 연소시간()을 비교하였다. 총 연소시간은 점화시간과 연소시간의 합으로, 보론 입자가 모두 소모될 때까지 소요되는 시간이다. Table 1은 본 연구에 적용된 보론 연소모델을 수증기의 유무에 따라 실험결과 및 선행연구자의 모델 결과와 비교를 나타낸다. 외기 압력은 1 atm이다. Fig. 3, 4는 각각 수증기가 없는 경우와 수증기가 있는 경우를 도식적으로 나타내었다. 대부분의 Case에서 선행 연구진의 결과에 비하여 동등 이상으로 실험결과와 유사함을 나타낸다.
Table 1.
Comparisons of burn time of a boron particle.
| Case | [msec] | ||||||||
|
Exp. [12] |
PSU [7,10] |
Hussmann [9] |
Chen [10] | Present | |||||
| 1 | 34.5 | 2280 | 0.23 | 0 | 21.0 | 48.67 | 24.29 | 19.69 | 19.36 |
| 2 | 34.5 | 2430 | 0.2 | 0 | 20.5 | 54.24 | 26.76 | 21.32 | 20.07 |
| 3 | 34.5 | 2870 | 0.23 | 0 | 11.2 | 44.91 | 20.45 | 13.2 | 13.29 |
| 4 | 34.5 | 2490 | 0.28 | 0 | 13.9 | 38.7 | 19.0 | 13.68 | 13.45 |
| 5 | 34.5 | 2450 | 0.37 | 0 | 9.8 | 29.91 | 29.59 | 14.15 | 10.6 |
| 6 | 34.5 | 2240 | 0.19 | 0.16 | 15.2 | 45.16 | 29.51 | 17.55 | 16.1 |
| 7 | 34.5 | 2330 | 0.21 | 0.16 | 14.0 | 42.72 | 25.47 | 15.3 | 13.8 |
| 8 | 34.5 | 2430 | 0.19 | 0.19 | 14.6 | 40.97 | 26.47 | 14.28 | 12.87 |
| 9 | 34.5 | 2640 | 0.2 | 0.21 | 9.6 | 37.82 | 22.94 | 11.63 | 10.4 |
4.2 반응률 특성
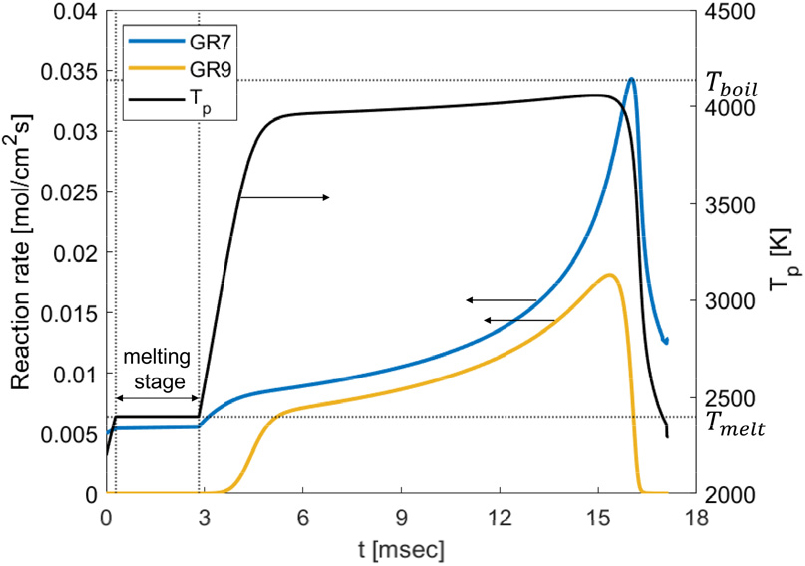
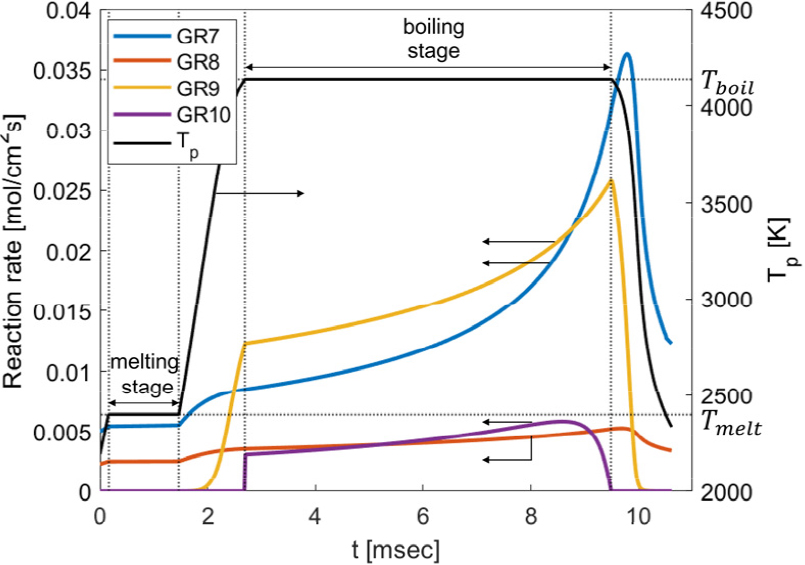
수증기 유무에 따라 반응율의 변화를 살펴보았다. 연소실 환경은 압력 1 bar, 외기 온도 2330 K, 유속 2.0 m/s, 초기 입자 온도 1860 K, 초기 입자 직경 34.5 , 산소 몰분율 0.21이다. 연소 단계에서 고려하는 반응은 4가지이며, GR7은 산소와 표면 반응, GR8은 수증기와 표면반응, GR9는 증발, GR10은 비등을 나타낸다. Fig. 5는 수증기는 없고 산소만 있는 경우이며 융해 구간(Melting stage)에서 GR7, GR9 반응률의 변화가 거의 없다. 이는 융해 구간에서 입자 온도는 일정하고, Fig. 2에서 알 수 있듯이 입자 직경 변화가 크지 않기 때문이다. GR9 반응률은 약 2 msec 이후 입자 온도가 3000 K 수준으로 도달한 후 급격히 상승한다. 해당 환경인자 조건에선 수증기 몰분율이 0이고, 비등점에 도달하지 않으므로 GR8, GR10은 배제되었다. 수증기 몰분율이 0.16인 조건(Fig. 6)에서는 수증기에 의한 반응인 GR8이 참여하며, 약 2.7~9.5 msec의 비등 구간(boiling stage)에서 GR10 반응률이 참여한다. 수증기가 없는 경우와 비교하여 연소시간이 약 30% 감소하며, 융해 구간도 짧아진다. GR7 반응률은 Fig. 5와 전구간 유사한 개형으로 증감하는 경향을 보이며, GR9은 입자 온도 상승으로 인해 반응률이 증가한다.
보론 입자가 비등점에 도달한 후 GR10 반응률 값은 점차 증가하다 약 9 msec 이후, 입자 직경 감소에 의한 외기로의 대류 열전달의 증가로 점차 감소한다.
GR7, GR9은 입자 온도가 상승하면 화학 반응속도가 증가하고(Eq. 24), 입자 직경이 감소하면 확산 반응(Eq. 25)이 증가한다. 따라서, 비등 구간 종료 이전까진 입자 온도 상승, 입자 직경 감소로 인해 반응률이 상승하며, 비등 구간 종료 후에도 입자 직경 감소에 따른 확산 반응 증가로 반응률이 증가한다. 이후, 급격한 입자 온도 감소로 화학 반응속도가 감소하여 반응률이 감소한다. GR9 반응률은 온도 변화가 없는 비등 구간에서의 기울기 크기가 상대적으로 작은 것으로 보아 입자 직경보다 입자 온도의 영향이 더 크다는 것을 의미한다. 따라서, 비등 구간 종료 후, 입자 온도 감소에 따라 반응률이 급감한다. GR10 반응률은 GR7, GR8, GR9에 의한 반응열과 대류, 복사 열의 차이이다. GR10 반응률은 GR7, GR8, GR9 반응률 증가에 따라 증가하다 이후 입자 직경 감소에 따른 대류 열방출의 증가로 감소한다. 반응률의 크기를 비교해보면 GR7, GR9이 비교적 큰 값을 가지며, GR8, GR10 반응률은 약 0.005 수준의 낮은 값을 가진다.
5. 결 론
본 연구에서는 기존 여러 논문을 조사하여 산제되어 있는 보론 연소 모델과 물성 및 반응 데이터를 종합하고 보론 연소의 수치해석 모델을 구성하였다. 보론 입자의 점화 및 연소 단계를 모두 모델링하여 선행연구의 실험 및 해석 결과와 비교하였으며 수증기의 유무의 모든 경우에서 본 연구에서 제안된 모델이 적절함을 제시하였다.
또한 수증기 유무에 따른 보론 연소의 반응률의 거동을 분석하였다. 동일한 환경 인자 조건에서 수증기가 없을 때 비등에 도달하지 못하였지만, 수증기가 있을 때 비등점에 도달하였다. 연소시간 또한 약 30%의 감소를 보였다. 연소 과정에선 보론의 표면 반응율(GR7)과 보론의 증발율(GR9)이 지배적이다. 이는 연소종료 부근까지 지속적으로 상승하다 입자가 작아지게 되면 급격히 감소한다.